
Biologia e Geologia
«Da Natureza, tire apenas fotos e deixe apenas pegadas»
Atividades práticas sobre rochas sedimentares
Material:
-
Água destilada;
-
Água da torneira (H2O);
-
Calcário em pó;
-
1 palhinha (para criar dióxido de carbono);
-
Lamparina;
-
1 mola de madeira;
-
4 tubos de ensaio;
-
Suporte para tubo de ensaio;
-
Pipetas;
-
Espátula.
Procedimento:
-
Montou-se as 4 provetas, identificadas com números de A a C', ordenadamente, no suporte das mesmas como mostra a fig 3;
-
De seguida, foi colocado no Tubo A água destilada até cerca de metade do tubo de ensaio;
-
No Tubo B foi colocado algumas gotas, com a ajuda de uma pipeta, de água da torneira (H2O) até cerca de metade do respetivo tubo e cálcario (em pó) cerca de 0.5 a 1cm do tubo de ensaio com a ajuda de uma espátula;
-
No Tubo C foi colocado água da torneira (H2O), calcário (em pó) e CO2 (dióxido de carbono) - ver nota.
-
Por fim, no tubo C' foi colocado as mesmas substâncias que o tubo C mas desta vez este tubo foi aquecido na lamparina, ou seja, o tubo C após o aquecimento.
Conclusão:
- Esquema da experiência:
Tubos Conteúdo Observações
A Água destilada ----
B Água destilada + Calcite em pó Água ficou turva; deposição de sedimentos.
C Água destilada + CO2 + Calcite em pó Dissolução da calcite na água (efervescência); líquido esbranquiçado; deposição de sedimentos.
C' Água destilada + CO2 + Calcite em pó - com aquecimento Observou-se o mesmo que no tubo C; durante o aquecimento a mistura entrou em efervescência libertando-se CO2.
Esta atividade propôs-me algumas questões depois de concluir o procedimento da mesma, as quais pretendo responder:
1. Indique qual o tubo a partir do qual se pode concluir:
- A elevação da temperatura provoca a precipitação de carbonato de cálcio. R: tubo C'
- O carbonato de cálcio não é solúvel na água pura. R: tubo B
- A água com CO2 rege com o carbonato de cálcio, formando um produto solúvel. R: tubo C
2. Com base nos resultados, explique como é que, na Natureza, se pode formar calcários de origem química.
R: Na formação de calcite que constitui o calcário, a precipitação desencadeia-se pela variação das condições químicas da água – como a diminuição do seu teor de CO2 – pelo que é designada de rocha de precipitação. Neste caso, o aumento da temperatura da água, diminuição da pressão atmosférica ou agitação das águas, originam uma diminuição do CO2 dissolvido, que implica que a reação se desloque no sentido da formação de CO2 e, portanto, da precipitação de calcite. A deposição e posterior diagénese dos minerais de calcite originam calcário que, neste caso, é de origem química.
Em consequência da circulação de águas acidifiadas pelo CO2 através das rochas calcárias, o carbonato de cálcio que as constitui solubilizado, formando hidrogenocarbonato que vai sendo removido. Assim a rocha fica modelada, formando, á superffície, um rendilhado de sulcos e cavidades conhecido por lapiaz e, no interior, formam-se grutas e galerias.
Na água que groteja do teto de uma gruta, cada gota abandonada no local de desprendimento uma película de carbonato de cálcio que, por acumulação sucessiva ao longo de muitos milhares de anos, forma estruturas pendentes chamadas estalactites.
O gotejar constante sobreb o solo da gruta também leva á acumulação sucessiva de películas de CaCO3, que formam estruturas ascendentes designadas estalagmites.
Quando as estalactites e as estalagmites se encontram formam uma coluna.
Esta experiência permite-nos observar o efeito das águas acidificadas no calcário, fenómeno que se pode encontrar no meio em que vivemos, através, por exemplo, das chuvas ácidas.
Neste caso, o efeito das chuvas é replicado com a utilização de calcite e água com dióxido de carbono, originando a libertação do mesmo.
As águas pluviais quando dissolvem CO2 ficam acidificadas (H2CO3) e estas, ao contactar com as rochas calcárias, reagem formando iões cálcio e iões hidrogenocarbonato. Estes iões dissolvem-se na água que percorre as galerias e, aquando um aumento da temperatura ou diminuição da pressão, dá-se a libertação de CO2 ocorrendo então, a precipitação do carbonato de cálcio – formação de calcários de precipitação (a reação deu-se no sentido inverso).




Fig 1: Calcário (em pó).
Fig 2: Calcário (em pó).
Fig 3: Tubos de ensaio ordenados pelas respetivas letras (A, B, C E C').
Fig 4: Tubos de ensaio já com as respetivas substâncias descritas no desenvolvimento.
Nota: Para criar CO2 foi usada uma palhinha. O ser humano inspira oxigénio e expira dióxido de carbono, por esse motivo foi usado uma palhinha para direcionar a nossa expiração até ao líquido do respetivo tubo de ensaio soprando pela mesma criando bolhinhas.




Fig 6: Tubo C' durante o aquecimento (na lamparina (à chama)).
Fig 7: Tubo C' após o aquecimento.
Fig 5: Substâncias vistas a olho nu dos tubos de ensaio.
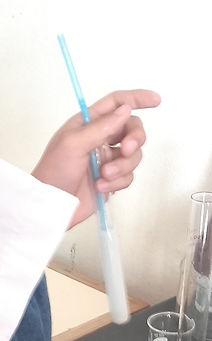
Fig 2: Uso de uma palhinha para a criação de CO2 (soprando pela mesma).
1. Qual é o efeito das águas com dióxido de carbono sobre os calcários?











2. Estará a porosidade das areias relacionada com a granulometria e com o grau de calibragem?
Material:
-
Tina retangular transparente com cerca de 5L de capacidade;
-
Água;
-
Proveta graduada;
-
1 a 2 Kg de argila;
-
1 a 2 Kg de areia grossa.
Procedimento:
-
Colocou-se 1/2 Kg de argila numa tina espalhando-a por toda a superficie;
-
Verteu-se lentamente a proveta graduada com água sobre a argila atés esta ficar um pouco húmida, tomando nota da quantidade que foi deitada;
-
Quando o líquido atingir exatamente a superfície da areia, pare de deitar água, registando a quantidade total de água gasta neste procedimento;
-
Procedeu-se do mesmo modo (passos 1, 2 e 3) para a areia grossa;
-
Calculou-se a porosidade em cada caso aplicando a seguinte relação:
P = ( Volume dos poros (= quantidade de água) / Volume total de areia ) x 100.
Fig 8: Pesou-se 1/2 Kg de argila para uma tina, numa balança.
Fig 9: Deitou-se o 1/2 Kg de argila para uma tina maior de diâmetro = 23 cm e espalhou-se a mesma por toda a base da tina. De seguida verteu-se a quantidade de água necessária para que a argila ficasse completamente húmida (255 mL) tomando sempre nota da mesma.

Fig 10: Procedeu-se do mesmo modo mas desta vez com a areia grossa. Despejou-se a argila num saco á parte e pesou-se novamente 1/2 Kg de areia grossa colocando a mesma na tina de diâmetro 23 cm procurando expandir a mesma por toda a base da tina. Verteu-se a quantidade necessária de água tomando sempre nota da mesma (200 mL).






Fig 11: Num outro tubo (D) colocou-se uma pequena quantidade de calcário para verificarmos a reação com HCL (10%) sendo que a calcário faz efeverscência na presença de HCL (10%).
Inicialmente mediram-se 250 g de cada material, que foi por sua vez colocado numa tina. Verteu-se água lentamente. Quando o liquído humedeceu todo material e apareceu à superficie parou-se de deitar água e registou-se o total de água gasta.
Procedeu-se aos cálculos:
Argila - 250g
Altura do material (h) = 1.7 cm
Quantidade de água = 255 cm^3
Área da base (Ab) = (pi).r^2 = pi x 11.5^2 = 415.5 cm^2
Área lateral da tina (Al) = 2.(pi).r.altura da tina = 2 x pi x 11.5 x 9.85 = 711.7 cm^2
Área total (Atotal) = 415.5 + 711.7 = 1127.2 cm^2
Volume (V) = Ab x h = 415.5 x 1.7 = 706.35 cm^3
Porosidade (P) = ( Volume dos poros (= quantidade de água) / volume total de areia ) x 100
P = (255 / 706.35) x 100
P = 36.10%
Areia grossa - 250g
Altura do material (h) = 1.5 cm
Quantidade de água = 149 cm^3
Área da base (Ab) = (pi).r^2 = pi x 11.5^2 = 415.5 cm^2
Área lateral da tina (Al) = 2.(pi).r.altura da tina = 2 x pi x 11.5 x 9.85 = 711.7 cm^2
Área total (Atotal) = 415.5 + 711.7 = 1127.2 cm^2
Volume (V) = Ab x h = 415.5 x 1.7 = 623.25 cm^3
Porosidade (P) = ( Volume dos poros (= quantidade de água) / volume total de areia ) x 100
P = (149 / 623.25) x 100
P = 23.90%
Conclusão:
O objetivo da atividade é comparar para o mesmo volume de argila e areia grossa, qual delas apresenta maior volume de poros, ou seja, do espaço vazio entre os grãos de areia.
O grau de calibragem avalia se as partículas de um mesmo solo possuem dimensões idênticas, ou se existe disparidade entre as partículas do solo. Diz-se que um solo está bem calibrado quando todas as partículas possuem o mesmo tamanho, e que está mal calibrado quando existe disparidade entre as dimensões das partículas do solo.
A existência de poros é evidanciada pelo facto de a água ser absorvida pela areia, isto é, o ar que circulava nos poros da areia saiu devido a entrada da água, que ficou a ocupar o seu lugar, não alterando o seu volume. Como não é possível determinar o volume de ar nos poros, utilizou-se a água, e a quantidade de água absorvida, é o volume dos poros do solo.
Quanto menor a granulometria das partículas, maior é o grau de porosidade das partículas pois maior é o número de poros existentes na solo. Quanto maior a granulometria das partículas, menor é o grau de porosidade, pois o número de espaços vazios é menor.
Quanto maior o grau de calibragem das partículas, menor é o grau de porosidade do solo, pois haverá menos espaço entre as partículas. Quanto menor o grau de calibragem, maior é a porosidade, pois haverá mais poros, visto que devido aos diferentes tamanhos das partículas, estas nao encaixam bem.
Assim, posso concluir que a argila (36.10) tem mais porosidade que a areia grossa (23.90), de acordo com os cálculos feitos acima.
3. Qual a importância do NaCl na deposição de materiais argilosos?
Material:
-
Argila;
-
Água;
-
Tubos de ensaio;
-
Suporte de tubos de ensaio;
-
Pipetas.
Procedimento:
-
Identificou-se os tubos de ensaio (1 e 2);
-
Colocou-se cerca de 1ml de argila em ambos os tubos de ensaio;
-
Adicionou-se cerca 5ml de água com a ajuda de uma pepita;
-
Deitou-se 5 ml de água e NaCl, mexendo até saturar, em um gobelé;
-
Deitou-se a mistura no tubo 2.

HCL
Tubo 1
Tubo 2
Conclusão:
No tubo de ensaio onde se misturou a argila com a solução de NaCl, verificou-se que a sedimentação ocorreu mais rapidamente. Tal facto deve-se à ocorrência de floculação, em que todas as partículas se unem, formando flocos de maiores dimensões e, consequentemente, com maior massa, depositando-se com maior velocidade.Deste modo, é possível concluir que o NaCl é um elemento muito importante na deposição de materiais argilosos, uma vez que acelera o processo de sedimentação, dado que a floculação ocorre devido à sua influência, formando depósitos (devido à actuação da força gravítica), que depois evoluem para rochas argilosas.
Fig 12: Tubo 1 e 2, verificando a deposição de sedimentos a superfície..
Todas as fotos aqui presentes são de autoria: Jéssica Constantino.